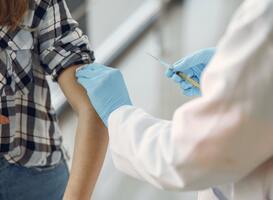
Grootschalige vaccinatieprogramma’s moeten de wereld verlossen van de ontwrichtende coronapandemie. Het Europees Medicijnagentschap EMA keurde eind 2020 het eerste coronavaccin goed, namelijk het mRNA-vaccin van Pfizer/BioNTech. Landen om ons heen begonnen vrijwel direct met de uitvoering van hun inentingsprogramma’s. Nederland hield zijn kruit nog even droog. Groot-Brittannië ‘vierde’ zijn Brexit alvast door op de troepen vooruit te lopen en op 8 december zijn eerste inwoner te vaccineren tegen het coronavirus. De 90-jarige Margaret Keenan werd er onder grote publieke belangstelling onsterfelijk mee.
Het Amerikaans/Duitse samenwerkingsverband Pfizer/BioNTech heeft de primeur. In september 2020 zette de Europese Commissie al in op een afname van 200 miljoen doses, met een optie voor nog eens 100 miljoen. De triomftocht van de aanvankelijke koploper, het zogeheten ‘Oxfordvaccin’ van AstraZeneca (Brits/Zweeds), begon in september 2020 te haperen. Er deed zich een nare bijwerking voor en het vaccin bleek onvoldoende bescherming te bieden. De verdere ontwikkeling van dit vaccin gaat onverdroten door. Nederland, Frankrijk, Duitsland en Italië hebben een gezamenlijke bestelling van circa 400 miljoen doses uitstaan.
Vaccins met stekels
Wereldwijd gingen de afgelopen maanden 47 bedrijven die zich hebben gestort op de ontwikkeling van coronavaccins van start met klinisch onderzoek. Daarvan bevinden zich circa tien testtrajecten in een vergevorderd stadium. Moderna/NIAID kreeg na Pfizer in zijn thuisland, de VS, al een spoedvergunning voor volwassenen vanaf 18 jaar. Naar alle waarschijnlijk wordt het Moderna-vaccin rond 6 januari voorwaardelijk toegelaten door de EMA. Het Moderna-vaccin is net als het Pfizer-vaccin een zogeheten mRNA-versie. Dit houdt in dat het vaccin werkt volgens het principe van een ‘boodschapper-RNA’ dat lichaamscellen ertoe aanzet zich uit te dossen met stekels en daarmee het covid-19 virus na te apen. Het lichaam begint dan direct afweer op te bouwen.
Neerlands hoop
De invalshoek of techniek die de diverse farmareuzen in het vroegste stadium kiezen bij de ontwikkeling van hun vaccins, hangt samen met eerder opgebouwde kennis en ervaring bij de bestrijding van andere virussen. Men borduurt als het ware voort op eerdere successen, volgens de onderzoekers van Janssen Vaccines in Leiden (Johnsson&Johnsson), door een landelijk dagblad Neerlands hoop genoemd als het aankomt op de ontwikkeling van een werkzaam coronavaccin. Johan van Hoof, kapitein op het schip bij Janssen Vaccines, noemt de inspanningen van zijn team ‘Een marathon op sprintsnelheid’. De druk is hoog, beslissingen worden snel genomen. “De onderzoeksfase die we normaal in twee jaar afleggen, voltooien we nu in twee maanden”, blogt Van Hoof.
Sinds januari 2020 wordt er in Leiden onafgebroken gewerkt aan de ontwikkeling van het coronavaccin. Op dit moment zetten ruim duizend eigen mensen en nog eens enkele duizenden medewerkers van externe partners zich in voor een succesvolle goedkeuringsprocedure. De ontwikkeling van het Janssen Covid 19-kandidaat-vaccin bevindt zich sinds eind december in een cruciale fase – fase 3 van het klinisch onderzoek. Er waren al meer dan 44.000 mensen bij het onderzoek betrokken. De resultaten zijn veelbelovend. “Het is een enorme operatie. Alleen al voor de eerste fase 3-studie hebben we bijvoorbeeld al meer dan tweehonderd actieve klinische centra aan ons verbonden, onmisbare partners waar de bloed- en swab-testen, de inmiddels bij iedereen bekende testen met het wattenstaafje, worden uitgevoerd,.”
Genetische code, afgeleid van succesvol Ebola-vaccin
Het covid-19 kandidaat-vaccin van Janssen is een zogeheten vector vaccin. Het is gebaseerd op een niet-replicerende adenovirale vector, een ‘virusdrager’ (Ad26) die de genetische code van SARS-CoV-2 bij zich heeft. Na vaccinatie komt de genetische code in het lichaam tot leven en gaat hij antistoffen opwekken. Bij het klinische onderzoek zijn en worden kleine deeltjes van de adenovirale vector toegediend, meestal in een volume van een halve millimeter.
De werking van het vaccin is gebaseerd op het eerdere, effectieve Ebola-vaccin dat Janssen in Leiden ontwikkelde en dat in het voorjaar is geregistreerd door de Europese Commissie. Dezelfde technologie ligt ten grondslag aan de ontwikkeling van vaccins tegen onder meer hiv, RSV en Zika. Als alle andere farmaceuten zette dus ook Janssen zijn eerste spoor uit op basis van eerder verworven kennis en ervaring. “We begonnen met twaalf verschillende theoretische mogelijkheden en technieken, de zogeheten vaccin-constructen”, leggen de onderzoekers van Janssen uit. “Van hieruit hebben we één lead-construct’ gekozen en twee constructen achter de hand gehouden als back-up. Het kandidaat-vaccin van dit moment is gebaseerd op ons eerste, meest belovende spoor.”
Klinisch onderzoek in beslissende fase
Na de keuze van de meest kansrijke lead-construct, gebaseerd op grote hoeveelheden onderzoeksresultaten, startte Janssen Vaccines met de klinische studies, onderverdeeld in drie fasen. In de eerste fase is bij een relatief kleine groep deelnemers getest op veiligheid, reactogeniteit (bijwerkingen) en immunogeniciteit (de mate waarin het vaccin in staat is om het lichaam immuun te maken voor het virus, ofwel de werkzaamheid). In de tweede fase is dit opnieuw onderzocht, maar dan met verschillende doseringen en doseringsintervallen. In de huidige derde fase is het onderzoek opgeschaald tot tienduizenden deelnemers en ligt de nadruk op het testen van de veiligheid en de effectiviteit. Het kandidaat-vaccin wordt hierbij afgezet tegen een placebo dat bij een deel van de proefpersonen is toegediend.
Janssen Vaccines: “Het is een uitermate intensief, nauwkeurig en spannend proces. Daarbij doen zich altijd teleurstellende momenten voor, waarop je terug moet naar de tekentafel. Omdat de effectiviteit te laag is, of als zich onverhoopt toch bijwerkingen voordoen, bijvoorbeeld. Pas als er een behoorlijke zekerheid bestaat over effectiviteit en veiligheid, starten de klinische onderzoeken, het testen op mensen. De werkzaamheid is cruciaal, uiteraard. Biedt het vaccin straks voldoende bescherming? Werkt het in alle leeftijdsgroepen? Maar de nadruk ligt op de veiligheid. Daar verzamelen we duizelingwekkende hoeveelheden data voor.”
“Bij het starten van klinische onderzoeken leggen de registratie-autoriteiten exact vast welke eindpunten ten minste gehaald moeten worden vóór we überhaupt een dossier mogen indienen. Dan hebben we het over eindpunten voor zowel de effectiviteit als de veiligheid. De goedkeurings- en registratie-autoriteiten beoordelen aan de hand van alle data of aan alle eisen is voldaan en of de voordelen van een kandidaat-vaccin opwegen tegen eventuele nadelen. Pas dán begint het officiële goedkeuringsproces.”
‘We houden de vaart erin, maar veiligheid gaat voor alles’
Dat proces is zeer intensief, volgens de experts van Janssen Vaccines. Er is weinig harmonisatie, dus voor ieder land moeten aparte dossiers worden gemaakt. Vanuit de registratie-autoriteiten worden honderden vragen afgevuurd op de vaccin-ontwikkelaars – specialistische en zeer kritische vragen die snelle en gevalideerde antwoorden vereisen om de vaart in het proces te houden. Die vaart is essentieel, gezien de wijze waarop het coronavirus nog steeds in golven om zich heen grijpt en gezien de mutaties die intussen actief zijn en besmettelijker lijken te zijn dan het ‘origineel’.
Onder ‘normale’ omstandigheden duurt de ontwikkeling en goedkeuring van vaccins tientallen jaren. Maar met covid-19 is niets meer ‘normaal’. Alles is anders, er is geen gebrek aan geld, er wordt achter de schermen veel samengewerkt, iedereen deelt het gevoel van urgentie. De snelheid waarmee vaccins beschikbaar komen roept ook vragen en twijfels op, maar er zijn goede verklaringen voor het tempo waarin successen worden geboekt.
Finish in zicht, productiecapaciteit uitgebreid
Janssen Vaccines: “Verschillende onderzoektrajecten die normaal gesproken ná elkaar plaatsvinden, zijn en worden nu parallel uitgevoerd. Dat geldt voor zowel de drie verschillende fasen van het klinisch onderzoek als het opstarten van de productie. Ook de verschillende onderdelen van het registratie-traject starten sneller en vinden parallel plaats. Dat levert veel tijdwinst op. Iedereen focust op één belang: voldoende effectieve en veilige vaccins om de wereld in 2021 coronavrij te maken.”
Of vaccinatie met de adenovirale vector van Janssen Vaccines uit Leiden aanstaande is, wil de farmaceut nog niet kwijt. Maar de finishlijn van de marathon op sprintsnelheid, zoals Johan van Hoof van Janssen Vaccines het noemt, is in zicht. En de kans op een lauwerkrans is groot. “De beoordeling van de eerste (pre-)klinische onderzoeksresultaten is al vergevorderd en veelbelovend. Alleen de meest recente data over werkzaamheid en veiligheid moeten nog worden beoordeeld om tot een afgewogen conclusie te komen over de toelaatbaarheid.”
Bij Janssen hebben ze er alle vertrouwen in, zo blijkt uit dit statement: “Als Janssen Vaccines hebben we diverse samenwerkingsovereenkomsten gesloten met fabrikanten om de gezamenlijke capaciteit voor het covid-19 vaccin te vergroten. Daarnaast breiden we hier ook onze eigen productiecapaciteit voor uit.”
Door: Ton Hilderink / Nationale Zorggids
















200mg hydroxychloroquine http://hydroxychloroquinex.com/
taldalafil https://tadalisxs.com/ tadalafil 5 mg
erectile pillole https://plaquenilx.com/ does erectile dysfunction get better
zytromax https://zithromaxes.com/ generic name for z pack
chloroquine amazon https://chloroquineorigin.com/ what is in chloroquine